Кисень. Озон. Цікава інформація
Фізичні властивості речовин, утворених елементом Оксигеном
Атоми Оксигену можуть утворювати два типи молекул: O2 — кисень та O3 — озон.
Явище існування кількох простих речовин, утворених атомами одного хімічного елемента, називається алотропією. А прості речовини, утворені одним елементом, називають алотропними модифікаціями.
Отже, озон і кисень — це алотропні модифікації елемента Оксигену.
Властивості
|
Кисень
|
Озон
|
Формула сполуки
|
O2
|
O3
|
Зовнішній вигляд у звичайних умовах
|
Газ
|
Газ
|
Колір
|
У парах кисень безбарвний. Рідкий — блідо-блакитного кольору, а твердий — синього
|
Пари озону світло-синього кольору. Рідкий — синього кольору, а твердий являє собою темно-фіолетові кристали
|
Запах і смак
|
Без запаху й смаку
|
Різкий характерний запах (у малих концентраціях надає повітрю запаху свіжості)
|
Температура плавлення
|
-219 °С
|
-192 °С
|
Температура кипіння
|
-183 °С
|
-112 °С
|
Густина при н. у.
|
1,43 г/л
|
2,14 г/л
|
Розчинність уводі
|
4 об’єми кисню в 100 об’ємах води
|
45 об’ємів озону в 100 об’ємах води
|
Магнітні властивості
|
Рідкий і твердий кисень — парамагнітні речовини, тобто втягуються в магнітне поле
|
Має діамагнітні властивості, тобто не взаємодіє з магнітним полем
|
Біологічна роль
|
Необхідний для дихання рослин і тварин (у суміші з азотом або інертним газом). Вдихання чистого кисню призводить до сильного отруєння
|
В атмосфері утворює так званий озоновий шар, який захищає біосферу від шкідливого впливу ультрафіолетового випромінювання. Отруйний
|
Хімічні властивості кисню й озону
Взаємодія кисню з металами
Молекулярний кисень — досить сильний окисник. Він окислює практично всі метали (окрім золота й платини). Багато металів повільно окислюються на повітрі, але в атмосфері чистого кисню згорають дуже швидко, при цьому утворюється оксид:
Однак деякі метали при горінні утворюють не оксиди, а пероксиди (у таких сполуках ступінь окиснення Оксигену дорівнює -1) або надпероксиди (ступінь окиснення атома Оксигену — дробова). Прикладом таких металів можуть бути барій, натрій та калій:

Взаємодія кисню з неметалами
Оксиген проявляє ступінь окиснення -2 в сполуках, які утворені з усіма неметалами, окрім Флуору, Гелію, Неону та Аргону. Молекули кисню при нагріванні безпосередньо вступають у взаємодію з усіма неметалами, окрім галогенів та інертних газів. В атмосфері кисню самозаймається фосфор та деякі інші неметали:
При взаємодії кисню із фтором утворюється оксиген фторид, а не фтор оксид, оскільки атом Фтору має більшу електронегативність, аніж атом Оксигену. Оксиген фторид — це газ блідо-жовтого кольору. Його використовують як дуже сильний окисник та фторувальний агент. У цій сполуці ступінь окиснення Оксигену дорівнює +2.
У надлишку фтору може утворюватися диоксиген дифторид, в якому ступінь окиснення Оксигену дорівнює +1. За будовою така молекула схожа на молекулу гідроген пероксиду.
За певних умов кисень вступає у взаємодію з багатьма складними речовинами. При цьому утворюються оксиди елементів або прості речовини, утворені цими елементами:
Кисень може вступати у взаємодію з оксидами, в яких елементи перебувають не у вищих ступенях окиснення:
Озон є більш сильним окисником, аніж молекулярний кисень. Майже всі реакції, які проходять під дією кисню, проходять також з озоном, але при цьому реакція протікає швидше й виділяється більша кількість енергії. Багато речовин під дією озону займаються:

При взаємодії калію з озоном утворюється озонід (сполука іонного типу):
Озон виявляють у лабораторних умовах пропусканням досліджуваної суміші через розчин калій йодиду з невеликою кількістю крохмалю:
Якщо в пропущеній газовій суміші присутній озон, то розчин забарвлюється в інтенсивно-синій колір, за рахунок утворення комплексної сполуки йоду з крохмалем. Цю реакцію називають якісною реакцією на озон.
Кисень в аналогічну реакцію не вступає.
Кисень зазвичай добувають у лабораторіях електролізом слабкого водного розчину натрій гідроксиду (електроди нікельовані):
Кисень можна добути термічним розкладанням багатих на Оксиген сполук (хлоратів, перманганатів, нітратів, пероксидів, оксидів):

У промисловості кисень добувають із рідкого повітря. Спочатку повітря охолоджують до -200 °С, а потім поступово нагрівають. При -196 °С випаровується азот, і залишається рідкий кисень.
Методи добування озону
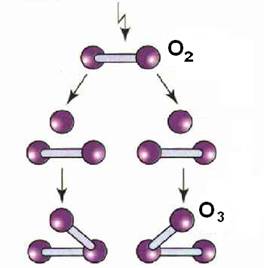
Озон утворюється в атмосфері на висоті 20— 30 кілометрів з кисню під дією ультрафіолетового випромінювання Сонця.
Озон можна добути з кисню під дією тліючого електричного розряду.
Він також утворюється в різних копіювальних апаратах, при зварюванні металів, при роботі трансформаторів та при ударі блискавки.
Застосування кисню й озону. Значення озонового шару
Кисень використовують усі аеробні живі істоти для дихання. У процесі фотосинтезу рослини виділяють кисень і поглинають вуглекислий газ.
Молекулярний кисень застосовують для так званої інтенсифікації, тобто прискорення окисних процесів у металургійній промисловості. А ще кисень використовують для добування полум’я з високою температурою. При горінні ацетилену (С2Н2) в кисні температура полум’я сягає +3500 °С. У медицині кисень застосовують для полегшення дихання хворих. Його також використовують у дихальних апаратах для роботи людей у важкій для дихання атмосфері. Рідкий кисень застосовують як окисник ракетного палива.
Озон використовують у лабораторній практиці як дуже сильний окисник. У промисловості з його допомогою дезінфікують воду, оскільки йому притаманна сильна окисна дія, яка знищує різні мікроорганізми.
Пероксиди, надпероксиди та озоніди лужних металів застосовують для регенерації кисню в космічних кораблях та на підводних човнах, Таке застосування засноване на реакції цих речовин з вуглекислим газом СО2:
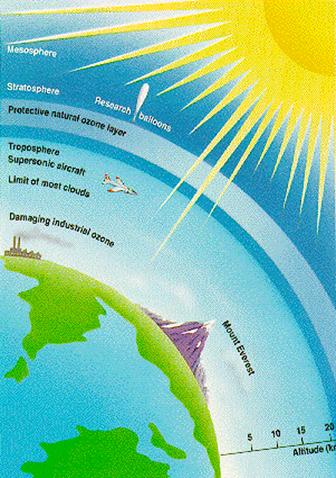
У природі озон міститься у високих шарах атмосфери на висоті близько 20—25 км, у так званому озоновому шарі, що захищає Землю від жорсткого сонячного випромінювання. Зменшення концентрації озону в стратосфері хоча б на 1 може призвести до важких наслідків, таких зростання числа онкологічних захворювань шкіри в людей і тварин, збільшення числа захворювань, пов’язаних із пригніченням імунної системи людини, уповільнення росту наземних рослин, зниження швидкості росту фітопланктону тощо.
Без озонового шару життя на планеті було б неможливим. Тим часом забруднення атмосфери різними промисловими викидами призводять до руйнування озонового шару. Найнебезпечнішими речовинами для озону є фреони (їх використовують як холодоагенти в холодильних машинах, а також як наповнювачі для балончиків з дезодорантами) та відходи ракетного палива.
Світове співтовариство було дуже стурбоване у зв’язку з утворенням діри в озоновому шарі на полюсах нашої планети, у зв’язку із чим у 1987 р. був прийнятий «Монреальський протокол щодо речовин, які руйнують озоновий шар», котрий обмежив використання речовин, шкідливих для озонового шару.
Схема утворення озону з кисню
Схема утворення озону з кисню
Озон у рідкому агрегатному стані-це фіолетова вибухонебезпечна речовина
Кисень у рідкому агрегатному стані-це голуба рідина.
Озонатор
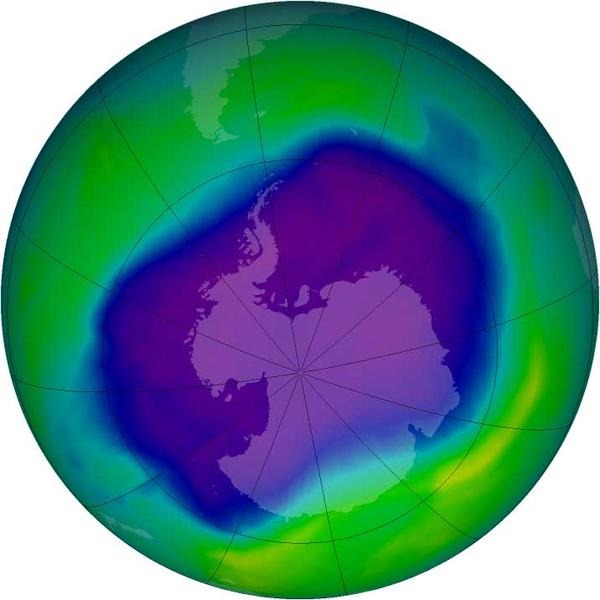
Розподіл озону на планеті.
Синій та фіолетовий колір-це низький вміст озону.
зелений-високий вміст
Озонатор


Немає коментарів:
Дописати коментар